GASES:
INTRODUCCIÓN:
Sabemos que lo gases son estados de la materia,
 bajo ciertas condiciones ya sea de temperatura,presión y volumen en donde moléculas interactuando entre si .
Por esto debemos saber las leyes y formulas que tienen los gases para tener en cuenta como se produce y que propiedades posee estos y es muy importante conocer cada procedimiento para aplicarlo , ademas practicarlos , es muy facil!! Sigue mirando el blog y lo encontraras todo.
bajo ciertas condiciones ya sea de temperatura,presión y volumen en donde moléculas interactuando entre si .
Por esto debemos saber las leyes y formulas que tienen los gases para tener en cuenta como se produce y que propiedades posee estos y es muy importante conocer cada procedimiento para aplicarlo , ademas practicarlos , es muy facil!! Sigue mirando el blog y lo encontraras todo.
OBJETIVOS:
*Conocer cada concepto de que comprende los gases
*Aprender el comportamientos de los gases.
*Diferenciar las leyes de gases que hay.
*Aprender las formulas de cada ley de gases.
 *Tener en cuenta la aplicación de cada ley.
*Tener en cuenta la aplicación de cada ley.
*Recordar conversiones ya que algunos casos lo utilizamos.
*Tener claro que 1 atmofera ------ 760 torr o 760 mm de hg.
*Realizar ejercicios que nos facilite este aprendizaje.
MARCO TEÓRICO:

*Para saber la ley de los gases primero debemos saber:
-¿Que es un gas?
Un gas es el estado de la materia en que las sustancias no tiene volumen ni forma propios sino que se adaptan al recipiente que los contiene.
las moléculas de un gas no tiene fuerza de atracción,por lo tanto en cualquier recipiente sin importar su tamaño,el gas lo ocupara completamente pues que poseen propiedades por las cuales se pueden expandir.

Propiedades de los gases
El gas no tiene volumen Propio: Presenta volumen igual al del recipiente donde se contiene.
No posee forma propia: Asume la forma del recipiente donde lo coloquemos.
Tiene gran compresibilidad: Capacidad de reducción de volumen, como también de expansibilidad, esto es, capacidad de doblar de volumen dependiendo de la presión a la que está sometido.
* En la licuefacción de un gas existe contracción de volumen
* La vaporización se caracteriza por el aumento de volumen
 Caracteristicas:
Caracteristicas:
*Los gases ocupan completamente el volumen del recipiente que los contiene.
*Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
*Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
*Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
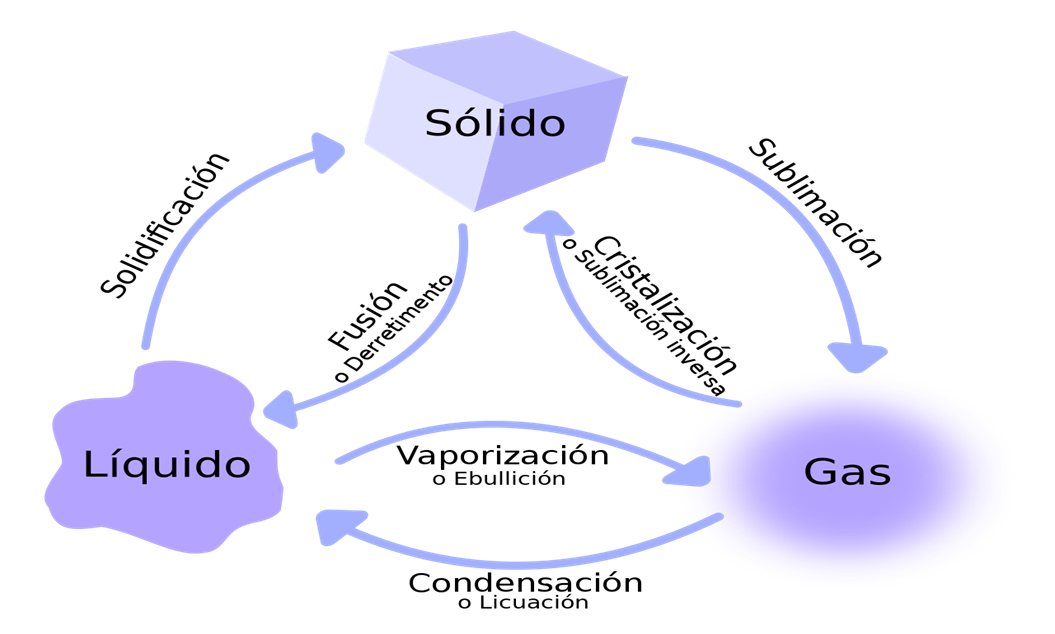
ESTADOS DE AGREGACIÓN DE LA MATERIA:
Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia.
En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
En el estado líquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
 En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta.
En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta.
-¿Que es masa?
-¿Que es temperatura?
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
¿Cómo se calibra un termómetro?
Mientras se está produciendo un cambio de estado la temperatura permanece constante y por ello consideramos los cambios de estado del agua (a 1 atm) como puntos de referencia.
Punto de fusión del agua:
La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
- Celsius: 0
- Kelvin: 273.15
- Fahrenheit: 32

Punto de ebullición del agua:
La fase líquida se encuentra en equilibrio con la fase gaseosa y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
- Celsius: 100
- Kelvin: 373.15
- Fahrenheit: 212
 En el intervalo de temperatura comprendido entre los puntos de fusión y ebullición, el agua permanece líquida. Este intervalo se divide en 100 partes en las escalas Celsius y Kelvin, mientras que en la escala Fahrenheit se divide en 180 partes.
En el intervalo de temperatura comprendido entre los puntos de fusión y ebullición, el agua permanece líquida. Este intervalo se divide en 100 partes en las escalas Celsius y Kelvin, mientras que en la escala Fahrenheit se divide en 180 partes.
-¿Que es presión?
En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:
P=FS
P=FS
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
1Pa=1Nm2
 Otra unidad muy utilizada para medir la presión, aunque no pertenece al Sistema Internacional, es el milímetro de mercurio (mm Hg) que representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura. Esta unidad está relacionada con la experiencia de Torricelli que encontró, utilizando un barómetro de mercurio, que al nivel del mar la presión atmosférica era equivalente a la ejercida por una columna de mercurio de 760 mm de altura.
Otra unidad muy utilizada para medir la presión, aunque no pertenece al Sistema Internacional, es el milímetro de mercurio (mm Hg) que representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura. Esta unidad está relacionada con la experiencia de Torricelli que encontró, utilizando un barómetro de mercurio, que al nivel del mar la presión atmosférica era equivalente a la ejercida por una columna de mercurio de 760 mm de altura.
En este caso la fuerza se correspondería con el peso (m⋅g) de la columna de mercurio por lo que
P=m⋅gS
Como la masa puede expresarse como el producto de la densidad por el volumen
(m=d⋅V), si sustituimos será:
P=d⋅V⋅gS
P=d⋅V⋅gS
y dado que el volumen es el producto de la superficie de la base por la altura (V=S⋅h), tenemos
P=d⋅S⋅h⋅gS
P=d⋅S⋅h⋅gS
y simplificando tenemos:
P=d⋅g⋅h
P=d⋅g⋅h
que nos permite calcular la presión en función de la densidad, la intensidad del campo gravitatorio y la altura de la columna.
Sustituyendo los correspondientes valores en la ecuación anterior tenemos que:
P=d⋅g⋅h=13600
kgm3⋅9,8Nkg⋅0,76m≊101300Nm2=101300Pa
Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor.
En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg):
-¿Que es el volumen?
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
Hay muchas unidades para medir el volumen. En este trabajo usaremos el litro (L) y el mililitro (mL)
Su equivalencia es:
1L = 1000 mL
Como 1 L es equivalente a 1 dm3, es decir a 1000 cm3, tenemos que el mL y el cm3 son unidades equivalentes
-CANTIDAD DE GAS:
La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol.
Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
¡¡¡ 602.200.000.000.000.000.000.000 !!!
La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:
Con el siguiente simulador puedes calcular las masas molares de algunas sustancias puras como el hidrógeno, el metano, el cloro y el yodo. La medida es correcta cuando se enciende el testigo rojo.
LEY DE GASES
Ley de Avogadro:
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
¿Por qué ocurre esto?
Vamos a suponer que aumentamos la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas aumentará la frecuencia de los choques con las paredes del recipiente lo que implica (por un instante) que la presión dentro del recipiente es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba inmediatamente. Al haber ahora mayor distancia entre las paredes (es decir, mayor volumen del recipiente) el número de choques de las moléculas contra las paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la animación anterior, también podemos expresar la ley de Avogadro así:
Vn=k
(el cociente entre el volumen y la cantidad de gas es constante)
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:
V1n1=V2n2 V1n1=V2n2
Ejemplo:
Solucion
-Ley boyle:
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
De acuerdo al enunciado, la ley de Boyle se expresa matemáticamente de la siguiente manera:
V1.P1 = V2.P2 (T= cte)
En donde:
V= Volumen.
P= Presión.
T= Temperatura, la cual permanece constante.
A continuación, puedes observar mediante unos ejercicios resueltos la aplicación de dicha expresión:
1. En un recipiente se tienen 30 litros de nitrógeno a 20°C y a una atmósfera de presión. ¿A qué presión es necesario someter el gas para que su volumen se reduzca a 10 litros?
· Primer paso: Identificar los datos que brinda el enunciado:
V1= 30 L
P1= 1 atm
V2= 10 L
T= 20°C
· Segundo paso: Conocer la incognita o interrogante:
P2= ?
· Tercer paso: Identificada la interrogante, se despeja la P2 de la expresión: V1.P1= V2.P2, quedando de la siguiente manera:
P2 = P1.V1
V2
· Finalmente se sustituyen los datos, y se efectúa el calculo matemático:
P2 = 1 atm . 30 L
10 L
Las unidades (litros) se cancelan, quedando:
P2 = 3 atm.
2. ¿Cuál será el volumen final ocupado por 50 litos de oxígeno cuya presión inicial es de 560 mm de Hg y es comprimido hasta que la presión es de 2 atmósferas? La temperatura se mantiene constante durante todo el proceso.
· Primer paso: Identificar los datos que brinda el enunciado:
V1= 50 L
P1= 560 mmHg
P2= 2 atm
T= cte.
· Segundo paso: Conocer la incognita o interrogante:
V2= ?
· Tercer paso: Existe una situación especial, como P2 está expresada en unidades diferentes a P1, se debe transformar una de las dos, ya sea en atm o mmHg. Por consiguiente transformaremos P2 a mmHg.
P2 = 2 atm . 760 mmHg = 1,520 mmHg
1 atm
· Cuarto paso: Identificada la interrogante, se despeja la V2 de la expresión:V1.P1 = V2.P2, quedando de la siguiente manera:
V2 = V1.P1
P2
· Finalmente se sustituyen los datos, y se efectúa el calculo matemático:
V2 = 50 L . 560 mmHg
1,520 mmHg
Las unidades (mmHg) se cancelan, quedando:
V2 = 18,42 litros.
¿Por qué ocurre esto?
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:
P⋅V=k
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
P1⋅V1=P2⋅V2
Ejercicio:
solucion
-LEY CHARLES:
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.


De acuerdo con el enunciado, la ley de Charles puede expresarse matemáticamente de la siguiente manera:
V1.T2 = V2.T1 (P=cte)
En donde:
V= Volumen.
T= Temperatura.
P= Presión, la cual es constante.
Observa la aplicación de dicha expresión a través de los siguientes ejemplos:
1. A 1,5 atmósferas y 25 °C el volumen de un gas es de 600 cm3, si la presión permanece inalterable ¿Cuál será el volumen del gas a 20 °C?
· Primer paso: Identificar los datos que se dan en el enunciado.
P1= 1,5 atm (cte)
T1= 25°C
V1= 600 cm3
T2= 20 °C
· Segundo paso: Conocer cual es la igcognita o interrogante.
V2= ?
· Tercer paso: Despejar V2 de la expresión: V1.T2 = V2.T1, quedando así:
V2= V1.T2
T1
· Cuarto paso: Transformar °C a K, de la siguiente manera:
T1: K= °C + 273 T2: K= °C + 273
K= 25 + 273= 298 K K= 20 + 273= 293 K
· Finalmente se sustituyen los valores y se realiza el calculo matemático.
V2= 600 cm3 . 293 K
298 K
Se cancelan las unidades (Kelvin) y se obtiene el resultado:
V2= 589,93cm3
2. Se tienen 0,2 litros de un gas a 30 °C y una atmósfera de presión ¿Qué temperatura hay que aplicarle para que aumente a 0,3 litros?
· Primer paso: Identificar los datos que se dan en el enunciado.
V1= 0,2 L
T1= 30 °C
P= 1 atm (cte)
V2= 0,3 L
· Segundo paso: Conocer cual es la igcognita o interrogante.
T2= ?
· Tercer paso: Despejar T2 de la expresión: V1.T2 = V2.T1, quedando así:
T2= V2.T1
V1
· Cuarto paso: Transformar °C a K, de la siguiente manera:
T1: K= °C + 273
K= 30 + 273= 303 K
· Finalmente se sustituyen los valores y se realiza el calculo matemático.
T2= 0.3 L . 303 K
0,2 L
Se cancelan las unidades (litros) y se obtiene el resultado:
T2= 454,5 K

¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
VT=k
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
V1T1=V2T2
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
EJERCICIO
-LEY COMBINADA:
el volumen de una muestra dada de gas es inversamente proporcional a su presion y directamente proporcional a su temperatura absoluta:
V1.P1 = V2.P2
______ ______
T1 T2
De acuerdo con el enunciado, se puede establecer la siguiente expresión matemática:
V1 . P1 = V2 . P2
T1 T2
En donde:
V= Volumen
P= Presión
T= Temperatura
Observa en los siguientes ejemplos la aplicación de dicha expresión:
1. Una masa gaseosa ocupa u volumen de 2,5 litros a 12 °C y 2 atm de presión. ¿Cuál es el volumen del gas si la temperatura aumenta a 38°C y la presión se incrementa hasta 2,5 atm?
· Primer paso: identificar los datos que brinda el enunciado.
V1= 2,5 L
T1= 12 °C
P1= 2 atm
T2= 38 °C
P2= 2,5 atm
· Segundo paso: Conocer la incognita.
V2= ?
· Tercer paso: Despejar V2 de la expresión V1 . P1 = V2 . P2 , quedando así:
T1 T2
V2= V1 . P1 . T2
T1 . P2
· Cuarto paso: Transformar las unidades de temperatura (°C) a Kelvin.
T1: K= °C + 273 T2: K= °C + 273
K= 12 + 273= 285 K K= 38 + 273= 311 K
· Quinto Paso: Sustituir los datos en la expresión y efectuar los calculos matemáticos.
V2= 2,5 L . 2 atm . 311 K
285 K . 2,5 atm
Se cancelan las unidades de presión y temperatura (atm y K), se obtiene el resultado.
V2= 2,18 L
Ejercicios ley Avogrado
1.
2
.
3.
4.
5.
Ejercicios Ley boyle
1.
2.
3.